Mavi şişe deneyi - Blue bottle experiment
mavi şişe deneyi renk değiştiren redoks Kimyasal reaksiyon. İçeren sulu bir çözelti glikoz, sodyum hidroksit, metilen mavisi bir miktar hava içeren kapalı bir şişede hazırlanır. Ayağa kalktıktan sonra kendiliğinden döner mavi -e renksiz. Ancak şişenin çalkalanması çözeltinin hızla tekrar maviye dönmesine neden olur. Daha fazla çalkalama ile bu renk değiştirme döngüsü birçok kez tekrarlanabilir.[1] Bu deney, laboratuvar derslerinde çalışmak için genel bir kimya deneyi olarak kullanılabilen klasik bir kimya gösterisidir. kimyasal kinetik ve reaksiyon mekanizması.[2] Tepki diğerleriyle de çalışır indirgeme ajanları glikoz dışında[3] ve diğeri redoks göstergesi metilen mavisinin yanı sıra boyalar.[4]
Tepkiler
Tarih ve genel kavram
Mavi şişe deneyinin mekanizması, oranları ve mekanizmalar karmaşık etkileşen kimyasal reaksiyonlar. Karmaşık kimyasal reaksiyonlarda, bireysel alt reaksiyonlar aynı anda ancak önemli ölçüde farklı oranlarda meydana gelebilir. Bunlar sırayla reaktiften etkilenebilir konsantrasyon ve sıcaklık. Çoğu durumda, genel reaksiyon hızı, en hızlı tek bileşenli reaksiyonla belirlenir. Bununla birlikte, bazı işlemler ara moleküller oluşturduğunda, daha sonra son ürünü oluşturmak için diğer işlemlerde reaksiyona girdiğinde, genel reaksiyon hızı, en yavaş reaksiyonun hızı ile belirlenir. Bu tür durumlarda ara ürünler genellikle düşük konsantrasyonlarda kararlı bir durumda bulunur çünkü bunlar oldukça reaktiftir.[7] Denge durumu, tüm reaksiyonun ileri ve geri mekanizmasının aynı hızda olmasını gerektirir.[8] Bu nedenle, genel net reaksiyon, hızın konsantrasyona ve sıcaklığa bağlı olduğu tüm mekanizma adımlarının toplamı ile belirlenir. Mavi şişe deneyi, reaksiyonların farklı oranlarda etkileşime girmesi ilkesini göstermektedir.[4]
Mavi şişe deneyi yalnızca üç reaktif gerektirir: Potasyum hidroksit çözüm, dekstroz çözelti ve seyreltin metilen mavisi çözüm. Bu reaktifler bir şişeye eklenir, karıştırılır ve şişe kapatılır. Solüsyonun başlangıç rengi mavidir, ancak kısa bir süre bekletildiğinde, alkalin dekstroz solüsyonu metilen mavisini renksiz hale getirdiği için kendiliğinden renksiz hale gelir. löko-metilen mavisi. Şişeyi çalkalamak kafa boşluğunda bulunan oksijenin çözelti içinde çözülmesine neden olur ve oksitlemek löko-metilen mavisi tekrar renkli formuna döner.[9] Başka bir varyasyon kullanır metilen mavisi Suda, glikoz, ve kostik soda (NaOH ).[10]
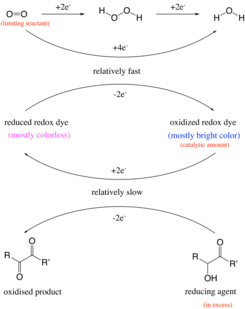
Geçmişte, reaksiyonun bir maddenin oksidasyonu ile meydana geldiği düşünülüyordu. aldehit gruplamak karboksilik asit altında alkali koşullar. Örneğin, glikoz okside olacak glukonat tarafından oksijen.[11] Bununla birlikte, deney ayrıca aşağıdaki gibi bileşiklerle de çalışır C vitamini ve benzoin bir aldehit grubu içermeyen.[4] Bu nedenle, reaksiyon aslında bir asilino Veya ilgili α -hidroksi -karbonil glukozun yapısal bir özelliği olan grubu 1,2 diketon.[12] İndirgenmiş redoks boyası (renksiz durum), oksitlenmiş redoks boyadan (mavi) oluşturulur. Mavi şişe deneyinde meydana gelen renk değişimi, bir saat tepkisi, burada bir veya daha fazla reaktifin konsantrasyonunda gözle görülür bir değişiklik, sınırlayıcı bir reaktifin tükenmesi üzerine aniden meydana gelir. Örneğin, sınırlayıcı reaktan olan oksijen, bir katalizör olarak safraninin yardımıyla başka bir reaktan olan benzoin tarafından tüketilir. Sınırlı miktarda oksijen tükendiğinde, katalizör formları değiştiremez ve sonuç olarak çözelti renk değiştirir.

Klasik versiyon
Klasik reaksiyondaki sulu çözelti şunları içerir: glikoz, sodyum hidroksit ve metilen mavisi.[13] İlk adımda bir asilino glikoz oluşur. Sonraki adım bir Redoks reaksiyonu glukozun okside olduğu metilen mavisi ile asilinin diketone alkali çözelti içinde[6] ve metilen mavisi, renksiz lömetilen mavisine indirgenir. Yeterli oksijen varsa (yani, şişeyi çalkaladıktan sonra), lömetilen mavisi hemen metilen mavisine yeniden oksitlenir ve çözeltinin mavi rengi devam eder. Bununla birlikte, çözelti dinlenmeye bırakıldığında, çözünmüş oksijen kademeli olarak tüketilir ve tamamen tükendiği noktada, metilen mavisinin glikoz indirgemesi karşı konulamaz ve çözeltinin rengi hızla kaybolur.[14] Tepki birinci derece glikoz, metilen mavisi ve hidroksit iyonu ve oksijende sıfır sırası. Süreç şu şekilde tanımlanabilir: sözde birinci dereceden tepki ve çözelti maviden renksiz duruma geçerken reaksiyon boyunca reaktiflerin değişen konsantrasyonlarını göstermek için kullanılabilir.[1]
Sodyum glukonatın yanı sıra nihai glikoz oksidasyon ürünleri, D-arabino-heksos-2-uloz (glukozon), bir format anyonunun ayrılmasından sonra D-arabinonat anyonu ve arabinonik asit.[12]
Yeşil versiyon
Wellman ve Noble, Mavi Şişe deneyi için C vitamininin glikoz yerine indirgeyici bir madde olarak hizmet ettiği yeni bir formülasyon önerdi; metilen mavisi ve oksijen hala kullanılmaktadır.[15] Bakırın yeniden oksitlenmesi için katalizör olarak eklenir lömetilen mavisi -e metilen mavisi. Bu modifikasyonlar, daha az aşındırıcı ve nötralize edilmesi daha kolay olan daha az miktarda atık üreten bir deney verir ve bu nedenle yeşil Kimya değişiklik.[16]
Hızlı versiyon
Chen[17] Benzoinin otoksidasyonu, klasik ve yeşil versiyonlara göre benzer bir deney gerçekleştirmiştir. Olduğu bulundu trafik ışığı ve sevgililer gününün kaybolması şeker eklenip eklenmediğine bakılmaksızın deneyler başarılı olabilir. Bir varyasyon daha hızlıdır, renk değişim döngülerinin sayısı klasik ve yeşil versiyonlar kadar uzun sürmez çünkü reaktanlar daha küçük miktarlarda mevcuttur; ayrıca, bu deney için indirgeme ajanı, çözeltideki döngü sayısını arttırmaya yardımcı olmak için eklenen benzoindir. Üstelik bu deneyde kullanılabilir süre oldukça kısadır. Deney gece boyunca hazırlansa da, çözeltiyi daha fazla gözlemleyebilmek için indirgeyici ajan herhangi bir zamanda eklenebilir.[18]
Enzimatik versiyon
Columbia Üniversitesi'nden Zhang, Tsitkov ve Hess[19]"mavi şişe deneyinin" enzimatik bir versiyonunu önerdi. Sistem yeşil renkte olduğundan ve reaktifler klasik yaklaşımlardan daha güvenli olduğundan buna "yeşil şişe deneyi" adını verdiler. Deney, iki ortak enzim içeren berrak bir cam şişede gerçekleştirilir (glikoz oksidaz ve yabanturpu peroksidaz ), glikoz ve 2,2'-azino-bis (3-etilbenzotiazolin-6-sülfonik asit) (ABTS olarak kısaltılır) PBS tamponunda. Solüsyonu havadan bloke etmek için ince bir yağ tabakası kullanılır. Çözelti önce yeşile döner ve sonra çözünmüş oksijenin tükenmesiyle renksiz hale gelir. Çözeltinin çalkalanması taze oksijen sağlar ve oksijen tüketilene kadar çözeltiyi tekrar yeşile renklendirir.
Bu versiyon, üç enzimatik reaksiyona dayanmaktadır. İlk olarak, glikoz oksidaz, oksijen varlığında glikozun oksidasyonunu katalize eder ve hidrojen peroksit üretir. İkincisi, yaban turpu peroksidazı, ABTS'yi radikal katyonik formu olan ABTS'ye oksitlemek için hidrojen peroksidi kullanır.+•. Çözeltide çözünmüş oksijen tüketildiğinde üçüncü reaksiyon meydana gelir: glikoz oksidaz, ABTS'nin azalmasını katalize eder.+• glikoz varlığında ABTS'ye geri dönün. Bu sistem aynı zamanda reaksiyona bağlı Rayleigh-Bénard konveksiyonundan kaynaklanan güzel modeller oluşturabilir.[20]
Boyaların çeşitliliği
Mavi şişe deneyindeki kimyasal reaksiyonlar ve mekanizma, bir şekerin hava yardımıyla oksidasyonuna ve bazik bir çözelti içinde bir redoks boyasına dayanır. Bu reaksiyonun diğer varyasyonları, dört aileyi kullanan rapor edilmiştir. redoks boyalar: tiazinler, oksazinler, Azinler, ve çivit mavisi hepsinin birlikte çalıştığı bildirildi glikoz ve kostik soda.[18]
Kimyasal trafik ışığı deneyi
Kimyasal trafik ışığı, renk değiştiren bir redoks reaksiyonudur. mavi şişe deneyi. Erken formüllerden biri şunlardan oluşur: glikoz, sodyum hidroksit, çivit mavisi, ve Su. Başka bir formül şunlardan oluşur: çivit mavisi boya askorbik asit (C vitamini ), sodyum bikarbonat, sodyum klorit, bakır (II) sülfat, sodyum hidroksit ve Su.[16] Böyle yaparak, kimyasal atık ve seviyesi aşındırıcı kimyasallar azalır. Deneyde çözülen katı kimyasalların miktarı 60 gramdan 6 grama düşürülebildi. Ve pH 13'ten 3'e düşürülebilir, bu da pH'ı 7'ye nötralize etmek daha kolaydır. karbonat atmadan önce.[15] Ayrıca, daha güvenlidir ve reaksiyonlar da daha hızlı gerçekleşir ve gerçekleştirilmesi daha kolaydır.
İlk önce tüm kimyasallar birbirine eklenir ve renk sarı görünür. Çalkalandıktan sonra renk yeşile döner ve dokunulmadan bırakıldığında kırmızıya döner. Daha fazla gözlemlendiğinde, renk sarıya döner, bu nedenle çözüme kimyasal trafik ışığı denir. Bu reaksiyon birçok kez tekrarlanabilir, ancak ek ihtiyacı vardır. oksijen veya çivit mavisi.

Bu reaksiyon, alkalin glukoz çözeltisinin bir indirgen madde. Glikoz çözeltisi, içeren çözeltiye eklenir. gösterge (boya indigo karmin) renk değişiklikleri meydana gelir. Bu reaksiyon aynı zamanda kimyasal saat deney çünkü ürünlerin ve reaktanların konsantrasyonları belirli bir süre içinde değişti.[21] Çözelti çalkalandığında, oksijen çözelti içinde çözünür ve indigo karminini okside eder. Az miktarda oksijen çözülürse çözelti kırmızı olur ve indigo karmininin tamamı oksitlenirse yeşil olur.[22] Oksijen konsantrasyonu düştüğünde çözelti orijinal sarı renge dönecektir.[23]
Kimyasal trafik ışığı reaksiyonu hızlandırılmış

Kimyasal trafik ışığı reaksiyonu (sarı)

Kimyasal trafik ışığı reaksiyonu (kırmızı)

Kimyasal trafik ışığı reaksiyonu (yeşil)
Sevgililer Günü deneyi kayboluyor
Kaybolan sevgililer günü deneyi, diğer bir kimyasal reaksiyondur. mavi şişe deneyi. Bu reaksiyon, su, glikoz, sodyum hidroksit, ve resazurin bir şişede karıştırılır. Çözelti sallandığında açık maviden kırmızımsı bir renge dönüşür. Çözelti bir süre bekletildikten sonra açık maviye döner. Bu reaksiyon birkaç kez tekrar edilebilir.[24]
Tüm bileşenleri karıştırdıktan sonra şişeyi sallayın ve solüsyondaki resazurin miktarına bağlı olarak renk kırmızıya veya pembeye dönecektir. Daha fazla resazurin, solüsyonun rengi ve kırmızı rengin yoğunluğunu geri döndürmesi için daha fazla zamana ihtiyaç duyulmasına neden olacaktır.

Kimyasal reaksiyon, resazurini resorufine indirgemek için glikozu uyarır. Daha sonra tekrar dihidroresorufin adı verilen renksiz bir bileşiğe indirgenecektir. Dihidroresorufin çalkalandığında, resorufine oksitlenir. Bunun nedeni, çalkalamanın şişedeki oksijenin oksitlenmiş dihidroresorufin'e yeniden resorufine dönüşmesi ile sonuçlanmasıdır.[25]
çözüm renksizden kırmızıya dönüşür
deneyin rengi azaldı
deneyin oksitlenmiş rengi
Diğerleri
- Gatorade
Erioglaucine bir gıda renklendiricisi ve bir redoks boyasının, mavi şişe deneyinde metilen mavisi için etkili bir ikame olduğu bulunmuştur. Bazı şekerler ve içecekler gibi Gatorade boya ve bir indirgeme şekeri içerir, bu gıda ürünlerini mavi bir şişe çözeltisine dönüştürmek için yalnızca sodyum hidroksit eklenmesi gerekir.[26]
- Mor şişe
Tiyonin Mor balon oluşturmak için bakır / demir katalizörü ile birlikte deneyin yeşil versiyonunda kullanılabilir.[27]
Desen oluşumu
Desen oluşumu NaOH, glikoz ve boya içeren bir solüsyonun bir Petri kabı bu atmosfere açık.[28] Bu, çözümün yapısını belirli bir süre içinde değiştirmesine neden olacaktır. Yapılar, moleküler taşınmadan ortaya çıkar. yayılma ve kimyasal kinetik. Petri kabında oluşan desenler mozaik desen olarak tanımlanabilir; ağ benzeri, dinamik sarmal, dallanma ve birbirine bağlanan çizgiler.[29]
Model oluşumundaki değişiklikler homojen değildir ve birkaç faktörden etkilenebilir. Çözeltideki farklı boya türleri, bağ oluşumu nedeniyle aynı deseni verecektir ve dinamikler aynı kalacaktır, bunun nedeni çözeltinin boya ile aynı renge sahip olmasıdır. Farklı miktarlarda boya, çözeltide yoğunluk değişikliğine neden olabilir ve bu, konvektif hareketin değişmesine neden olur. Farklı miktarlarda boya, aynı zamanda farklı miktarlarda glikoz ve oksitlenmiş ürün tarafından oluşturulan farklı miktarlarda geleneksel hücreler getirebilir. Bu ilginç bir uzaysal fenomen ile sonuçlanabilir. Zaman, kalıp oluşumunu da etkileyebilir. Zaman geçtikçe, bir model yavaş yavaş kayboldu. Spiraller ve dallar kaybolmaya başladı ve sonunda tamamen kayboldu. Bu gerçekler gösteriyor ki oksijen kimyasal reaksiyonu etkiler ve bu, model oluşumunda temel bir rol oynar. Model oluşumu ayrıca kimyasal olarak tahrik edilen konvektif bir kararsızlıktan da oluşabilir. Bu, kimyasal sistemlerin moleküler yapısındaki dalgalanmalar nedeniyle maddenin hava-reaksiyon karışımı arayüzünde değiş tokuş edildiği anlamına gelir.[30] Sıcaklık, desen oluşumunu etkileyebilir.[6] Daha soğuk sıcaklık, sıcaktan daha net bir model oluşturdu. Petri kabının şekli de desen oluşumuna katkıda bulundu.[6]
Buzlu Su Banyosunda Hızlandırılmış Mavi Şişe Deneyinden Desen Oluşumu

Buzlu Su Banyosunda Mavi Şişe Deneyinden Desen Oluşumu
Soğuk Su Banyosunda Hızlandırılmış Mavi Şişe Deneyinden Desen Oluşumu

Soğuk Suda Mavi Şişe Deneyinden Desen Oluşumu
Oda Sıcaklığında Hızlandırılmış Mavi Şişe Deneyinden Desen Oluşumu

Oda Sıcaklığında Mavi Şişe Deneyinden Desen Oluşumu
Sıcak Su Banyosunda Hızlandırılmış Mavi Şişe Deneyinden Desen Oluşumu

Ilık Su Banyosunda Mavi Şişe Deneyinden Desen Oluşumu
Farklı Şekildeki Konteynerlerde Kimyasal Trafik Işığı Deneyi Desen Oluşumu Hızlandırılmış

Farklı Biçimli Konteynerlerde Kimyasal Trafik Işığı Deney Modeli Oluşumu
Bir grup araştırmacı Glasgow Üniversitesi Pons, Batiste ve Bees, metilen mavisi glikoz sistemindeki desen oluşumu hakkında küçük bir sonuç çıkardı. Erişilebilir oksijene sahip bir kapta benzer bir model oluşturulabileceğine dair kesin bir açıklama yaptılar. Ortaya çıkan bu yüzey gerilimi etkisi, kararsızlığı oluşturmak için gerekli değildir. Kabın kapağında, oksijenin erişemediği, ince, mavi ve daha düşük miktarda oksijenle sonuçlanan küçük delikler de bulundu. Viskozite ve sıvı derinliğindeki farklılıklar nedeniyle desen uzunluğu ve zaman ölçeği deneylerinden birinde araştırılmıştır. Deney ortaya koyuyor ki dalga boyu Bir desen hızla oluşmaya başladığında oluşur. Daha sonra dalgaboyu veya desen bir süre korunabilir veya salınabilir.[31]
Referanslar
- ^ a b Baker, Colin (1 Kasım 2006). "'Mavi şişe' tepkisi". Kimyada Eğitim. Cilt 43 hayır. 6. Kraliyet Kimya Derneği. s. 155.
- ^ Engerer, Steven C .; Cook, A. Gilbert (1999). "Reaksiyon Mekanizmaları Üzerine Genel Kimya Deneyi Olarak Mavi Şişe Reaksiyonu". Kimya Eğitimi Dergisi. 76 (11): 1519–1520. doi:10.1021 / ed076p1519.
- ^ Cook, A. Gilbert; Tolliver, Randi M .; Williams, Janelle E. (1994). "Mavi Şişe Deneyi Yeniden Ziyaret Edildi: Ne Kadar Mavi? Ne Kadar Tatlı?". Kimya Eğitimi Dergisi. 71 (2): 160. Bibcode:1994JChEd..71..160C. doi:10.1021 / ed071p160.
- ^ a b c Limpanuparb, Taweetham; Areekul, Cherprang; Montriwat, Punchalee; Rajchakit, Urawadee (2017). "Mavi Şişe Deneyi: Kimyasalları Bilmeden Kimya Öğrenmek". Kimya Eğitimi Dergisi. 94 (6): 730. Bibcode:2017JChEd..94..730L. doi:10.1021 / acs.jchemed.6b00844.
- ^ Limpanuparb, Taweetham; Roongruangsree, Pakpong; Areekul, Cherprang (2017). "Mavi şişe deneyinin bir DFT incelemesi: redoks göstergeleri tarafından katalize edilen otoksidasyonun E ∘ yarı hücre analizi". Royal Society Açık Bilim. 4 (11): 170708. doi:10.1098 / rsos.170708. PMC 5717635. PMID 29291061.
- ^ a b c d Limpanuparb, Taweetham; Ruchawapol, Chattarin; Pakwilaikiat, Pooh; Kaewpichit, Chatchapong (2019). "Redox Boyalarla Katalize Edilen Otoksidasyonlarda Kimyasal Modeller" (PDF). ACS Omega. 4 (4): 7891–7894. doi:10.1021 / acsomega.9b00802.
- ^ Campbell, J.A. (1963). "Erken ve Sıklıkla Kinetik". Kimya Eğitimi Dergisi. 40 (11): 578–583. doi:10.1021 / ed040p578.
- ^ Mickey, Charles D. (1980). "Kimyasal Kinetik: Reaksiyon Hızları". Kimya Eğitimi Dergisi. 57 (9): 659. doi:10.1021 / ed057p659.
- ^ Dutton, F.B. (1960). "Metilen Mavisi - İndirgeme ve Oksidasyon". Kimya Eğitimi Dergisi. 37 (12): A799. doi:10.1021 / ed037pA799.1.
- ^ Limpanuparb, Taweetham; Ruchawapol, Chattarin; Sathainthammanee, Dulyarat (2019). "Clock Reaction Revisited: Catalyzed Redox Substrate-Depletive Reactions". Kimya Eğitimi Dergisi. 96 (4): 812−818. doi:10.1021 / acs.jchemed.8b00547.
- ^ Olah, Herbert W. Roesky (2007). Muhteşem kimyasal deneyler (1. Aufl. Ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-31865-0.
- ^ a b Anderson, Laurens; Wittkopp, Stacy M .; Ressam, Christopher J .; Liegel, Jessica J .; Schreiner, Rodney; Bell, Jerry A .; Shakhashiri, Bassam Z. (2012). "Mavi Şişe Ağardığında Ne Oluyor: Glikozun Metilen Mavisi Katalizeli Hava Oksidasyonunun İncelenmesi". Kimya Eğitimi Dergisi. 89 (11): 1425–1431. doi:10.1021 / ed200511d.
- ^ Shakhashiri, Bassam Z. (1985). Kimyasal gösteriler ([Nachdr.] Ed.). Madison, Wis .: Üniv. Wisconsin Press. s. 142–143. ISBN 978-0-299-10130-5.
- ^ Summerlin, Lee R. (1988). Kimyasal gösteriler (2. baskı). Washington, DC: American Chem. Toplum. s. 127. ISBN 9780841214811.
- ^ a b Wellman, Whitney E .; Noble, Mark E .; Healy, Tom (2003). "Mavi Şişeyi Yeşillendirmek". Kimya Eğitimi Dergisi. 80 (5): 537. Bibcode:2003JChEd..80..537W. doi:10.1021 / ed080p537.
- ^ a b Rajchakit, Urawadee; Limpanuparb, Taweetham (2016). "Trafik Işığını Yeşillendirme: Göstergelerle Katalize Edilen C Vitamininin Havada Oksidasyonu". Kimya Eğitimi Dergisi. 93 (8): 1486–1489. Bibcode:2016JChEd..93.1486R. doi:10.1021 / acs.jchemed.5b00630.
- ^ Chen, Philip S. (1970). "Benzoinin otoksidasyonu". Kimya Eğitimi Dergisi. 47 (1): A67. Bibcode:1970JChEd..47 ... 67C. doi:10.1021 / ed047pA67.1.
- ^ a b Rajchakit, Urawadee; Limpanuparb, Taweetham (2016). "Hızlı Mavi Şişe Deneyi: Redox Göstergeleri Tarafından Katalize Edilen Benzoin'in Otoksidasyonu". Kimya Eğitimi Dergisi. 93 (8): 1490–1494. Bibcode:2016JChEd..93.1490R. doi:10.1021 / acs.jchemed.6b00018.
- ^ Zhang, Yifei; Tsitkov, Stanislav; Hess, Henry (2018). "Substrat rekabeti olan iki enzimli bir reaksiyon ağında karmaşık dinamikler". Doğa Katalizi. 1 (4): 276–281. doi:10.1038 / s41929-018-0053-1.
- ^ Burada bir film bulunabilir: Yeşil şişe deneyi
- ^ Mann, Georgia. "Kimya Haftası: Kimyasal trafik ışığı". Alındı 17 Temmuz 2019.
- ^ "Kimyasal Trafik Işığı". MEL Bilim. Alındı 17 Temmuz 2019.
- ^ Altott, Nisan. "Trafik ışığı". Alındı 17 Temmuz 2019.
- ^ "Kaybolan Sevgililer Günü Kimyası Gösterisi". Alındı 13 Kasım 2015.[kalıcı ölü bağlantı ]
- ^ "Kaybolan Sevgililer Günü" (PDF). Arşivlenen orijinal (PDF) 16 Şubat 2016'da. Alındı 13 Kasım 2015.
- ^ Campbell, Dean J .; Staiger, Felicia A .; Peterson, Joshua P. (2015). "FD&C Blue # 1 İçeren Yiyecek Öğelerinin Kullanıldığı" Mavi Şişe "Gösterisinde Çeşitlemeler". Kimya Eğitimi Dergisi. 92 (10): 1684–1686. doi:10.1021 / acs.jchemed.5b00190.
- ^ Weinberg Richard B. (2019). "Mor Şişe: Mavi Şişe Reaksiyonunun Yeni Bir Reformülasyonu". Kimya Eğitimi Dergisi. doi:10.1021 / acs.jchemed.9b00627.
- ^ Adamcíková, L'ubica; Sevcík, Peter (1998-12-01). "Mavi Şişe Deneyi - Kendi Kendine Örgütlenmenin Basit Gösterimi". Kimya Eğitimi Dergisi. 75 (12): 1580. doi:10.1021 / ed075p1580. ISSN 0021-9584.
- ^ Pons, A. J .; Sague's, F .; Bees, M. A .; Sørensen, P. Graae (2000). "Metilen-Mavi-Glikoz Sisteminde Desen Oluşumu". Fiziksel Kimya B Dergisi. 104 (10): 2251–2259. doi:10.1021 / jp9935788.
- ^ Adamčíková, L`; Ševčík, P. (1997). "Bu Sistemdeki Mavi Şişe Deneyi ve Desen Oluşumu". Z. Naturforsch. 52 (8–9): 650–654. doi:10.1515 / zna-1997-8-918.
- ^ Pons, A. J .; Batiste, O .; Arılar, M.A. (2008). "Metilen-mavi-glikoz sisteminde doğrusal olmayan kemokonveksiyon: İki boyutlu sığ tabakalar". Fiziksel İnceleme E. 78 (1): 016316. doi:10.1103 / PhysRevE.78.016316. hdl:2445/18933. PMID 18764059.