Sistatiyonin beta-liyaz - Cystathionine beta-lyase
| sistatiyonin beta-liyaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
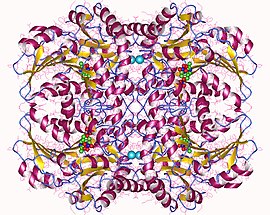 Sistatiyonin beta-liyaz tetramer, E.Coli | |||||||||
| Tanımlayıcılar | |||||||||
| EC numarası | 4.4.1.8 | ||||||||
| CAS numarası | 9055-05-4 | ||||||||
| Veritabanları | |||||||||
| IntEnz | IntEnz görünümü | ||||||||
| BRENDA | BRENDA girişi | ||||||||
| ExPASy | NiceZyme görünümü | ||||||||
| KEGG | KEGG girişi | ||||||||
| MetaCyc | metabolik yol | ||||||||
| PRIAM | profil | ||||||||
| PDB yapılar | RCSB PDB PDBe PDBsum | ||||||||
| Gen ontolojisi | AmiGO / QuickGO | ||||||||
| |||||||||
Sistatiyonin beta-liyaz (EC 4.4.1.8 ), aynı zamanda yaygın olarak CBL veya β-sistatiyonaz, bir enzim öncelikle katalizler aşağıdaki α, β-eliminasyonu reaksiyon[1]

Böylece substrat bu enzimin L-sistatiyonin oysa 3 Ürün:% s vardır homosistein, piruvat, ve amonyak.[2][3][4]
İçinde bulunan bitkiler, bakteri, ve Maya sistatiyonin beta-liyaz, metiyonin biyosentez patika homosistein, doğrudan metiyonine dönüştürülebildiğinden metiyonin sentaz.[3][5][6] Enzim, kullanımı nedeniyle PLP'ye bağımlı enzimlerin γ ailesine aittir. piridoksal-5'-fosfat (PLP) kofaktör sistatiyonini parçalamak için.[7] Enzim ayrıca ailesine aittir. Liyazlar, özellikle karbon-kükürt liyazları sınıfı. sistematik isim Bu enzim sınıfının L-sistatiyonin L-homosistein-liyaz (deaminasyon; piruvat oluşturan). Bu enzim 5'e katılır metabolik yollar: metiyonin metabolizması, sistein metabolizması, selenoamino asit metabolizması, nitrojen metabolizması, ve kükürt metabolizması.
Yapısı
Sistatiyonin beta-liyaz bir tetramer özdeşten oluşur alt birimler ve bir dimer dimerlerin her biri bir molekül PLP'nin katalitik bölge tarafından lizin kalıntı.[6][8] Dimer, iki monomerler birkaç ile ilişkili elektrostatik, hidrojen bağı, ve hidrofobik etkileşimler tetramer, arasındaki etkileşimler yoluyla stabilize edilirken N terminali alanlar ve anahtar α-sarmallar.[3]
Enzimin katalitik bölge kalıntılarının çoğu, enzimler arasında korunur. transsülfürasyon yolu.[6] Diğer üyeler şunları içerir: sistatiyonin gama sentaz, sistatiyonin gama-liyaz, ve metiyonin gama liyaz.[9][10] Ek olarak, bu yapılar bir katladığım tip ve aittir aspartat aminotransferaz (AAT) ailesi, homodimerler ile karakterize edilir. dihedral simetri ve bitişik alt birimlere ait kalıntılardan oluşan aktif siteler.[11][12]

Monomer
Sistatiyonin beta-liyaz monomeri, işlevsel ve yapısal olarak farklı üç alandan oluşur:
N-terminal alanı
Üç α-helis ve bir beta iplik oluşumuna katkıda bulunan Kuaterner yapı.[6][13] Bu alan, substrat ve kofaktör bağlanmasını kolaylaştırmak için komşu alt birimin aktif sahası ile etkileşime giren kalıntıları içerir.[4]
PLP bağlayıcı alan
Enzim üzerindeki katalitik olarak ilgili kalıntıların çoğunu içerir. Farklı paralel yedi sarmallı β yapraklı α-sarmallardan ve β yapraklarından oluşur. Bu tabakalar, PLP bağlayıcı sarmalın etrafında eğimli bir yapı oluşturur. PLP, kovalent olarak bir lizin kalıntısına bağlanır. C-terminali sayfanın.[3][4]
C-terminal alanı
Uzun, kıvrımlı bir a-heliks ile PLP-bağlanma alanına bağlanan enzim üzerindeki en küçük alan. Etki alanı dört sarmallı olarak yapılandırılmıştır. antiparalel Komşu helisleri olan β-levha.[4]
Katalitik site
Bir lizin kalıntısına bağlanmanın yanı sıra PLP, katalitik kalıntılarla çeşitli etkileşimler yoluyla enzimin substrat bağlanma sahası içinde sabitlenir. Amin - ve hidroksil - içeren kalıntılar, dörde hidrojen bağlama mesafesinde bulunur. fosfat oksijen.[3] Bu fosfat grubunun, aktif bölgede PLP'nin korunmasına ana katkı sağladığı düşünülmektedir. Ek olarak, çevredeki kalıntılar piridin azot PLP'de stabilize etmesine yardımcı olun pozitif yük, böylece onun elektrofilik karakter.[14]
aromatik halka PLP'de neredeyse bir aynı düzlemde tirozin kalıntı. Bu konfigürasyonun, elektron kofaktörün lavabo karakteri. PLP ve aromatik arasındaki bu istifleme etkileşimleri yan zincirler Transaldiminasyonu kolaylaştırarak reaksiyonu katalize etmede önemli bir rol oynadığı için çoğu PLP'ye bağımlı enzimde bulunabilir.[15]

Mekanizma
Gösterildiği gibi mekanizma aşağıda, sistatiyonin beta-liyaz S-C'yi kolaylaştırır bağ katalitik bir lizin kalıntısına bağlanan bir PLP kofaktörünün kullanımı ile sistatiyonin içinde bölünme.[3][4] Başlangıçta bir protonsuz Transaldiminasyon reaksiyonunu gerçekleştirmek için amino grubuna ihtiyaç vardır.[13] Göz önüne alındığında pH Enzim için optimum 8.0 ile 9.0 arasındadır, katalitik cepte bir tirozin kalıntısı fenolat, substratın a-amino grubundan bir proton çıkarır.[5][6] Bir sonraki adımda protonsuz amin, bir nükleofilik bir oluşturmak için lizin saldırır ve yer değiştirir Schiff tabanı, bir iç oluşturan aldimin.
Serbest bırakılan lizin artık protonu C'den soyutlayabilir.α ve bir kinoid oluştur orta düzey tarafından kolaylaştırılan yerelleştirme PLP'nin konjuge üzerindeki negatif yükün p sistemi.[14] Daha sonra, S'nin protonasyonuγ C'yi indüklerβ-Sγ bağ bölünmesi, böylece homosistein salgılanması[3][13]
Dış aldimin, lizinin nükleofilik atağıyla yer değiştirir, katalitik olarak aktif iç aldimin rejenere olur ve salınır. dehidroalanin.[4] Son olarak, enamin totomerize eder Içine imine etmek geçen hidrolitik deaminasyon piruvat ve amonyak oluşturmak için.[16]

İnhibisyon
Bitki ve bakteriyel sistatiyonin beta-liyazlar, antimikrobiyal amino asit, L-aminoetoksibinilglisin (AVG) ve antibakteriyel amino asit, rizobitoksin.[3]
Bitkiler
Bitkilerdeki sistatiyonin beta-liyaz, enzimin geri dönüşü olmayan inaktivasyonundan önce tersine çevrilebilir bir enzim-inhibitör kompleksinin oluştuğu AVG ile iki aşamalı bir inaktivasyon süreci sergiler:

Aşırı sistatiyonin ilavesi, enzimin inaktivasyonunu önleyerek AVG'nin bir rekabetçi engelleyici sistatiyonin ile ilgili olarak.[5] Ek olarak, enzimin duyarlı olduğu gösterilmiştir. tiol -blocking inhibitörleri, örneğin N-etilmaleimid ve idoasetamid.[8][17]
Bakteri
Bitkilerden farklı olarak, bakterideki Sistatiyonin beta-liyaz, tek adımlı bir inhibisyon mekanizması sergiler:
Vasıtasıyla kinetik yöntemler ve X-ışını kristalografisi zamana bağlı, yavaş bağlanan bir inhibisyon gözlendi. İnhibitörün enzime substrata benzer şekilde bağlandığına inanılmaktadır; ancak, a-protonun soyutlanmasından sonra reaksiyon, bir inaktif ketimin PLP türevi yaratmaya devam eder.[18]

Evrim
Arabidopsis sistatiyonin beta-liyaz% 22'ye sahiptir homoloji onunla Escherichia coli bitki ve bakteri kaynaklarından gelen sistatiyonin λ-sentaz ve sistatiyonin λ-liyaz ile muadili ve hatta daha yüksek homoloji (% 28 ila% 36 arasında) Saccharomyces cerevisiae.[19] Bu enzimlerin tümü, Cys / Met biyosentetik yolu ve PLP'ye bağımlı enzimlerin aynı sınıfına aittir, bu da bu enzimlerin ortak bir atadan türetildiğini düşündürür.[6][20]
Endüstriyel alaka
Sistatiyonin beta-liyaz, metiyoninin doğrudan bir öncüsü olan homosisteinin üretimini katalize eder. Metiyonin, protein sentezi ve protein sentezi için gerekli olan bakteriler için gerekli bir amino asittir. S-adenosilmetiyonin; bu nedenle, amino asit doğrudan bağlantılıdır DNA çoğaltma. DNA replikasyonundaki gerekliliği nedeniyle, sistatiyonin beta-liyazın inhibisyonu çekici bir antibiyotik hedefidir.[21] Dahası, enzim insanlarda bulunmadığından zararlı ve istenmeyen olma olasılığını azaltır. yan etkiler.[22]
Çalışmalar, birkaç anti-fungal ajanın anti-fungal aktivitesini, sistatiyonin beta-liyazın inhibisyonuna bağlamıştır; ancak, diğer çalışmalar bunların enzim inhibisyonunu gözlemlememiştir. Sistatiyonin beta-liyaz inhibisyonunun mikrobiyal ve fungal büyüme üzerindeki tam kapsamını karakterize etmek için daha fazla araştırmaya ihtiyaç vardır.[21]
Referanslar
- ^ Dwivedi CM, Ragin RC, Uren JR (Haziran 1982). "Escherichia coli'den beta-sistatyonazın klonlanması, saflaştırılması ve karakterizasyonu". Biyokimya. 21 (13): 3064–9. doi:10.1021 / bi00256a005. PMID 7049234.
- ^ Flavin M, Slaughter C (Temmuz 1964). "Neurospora'nın Sistatiyonin Bölünme Enzimleri". Biyolojik Kimya Dergisi. 239: 2212–9. PMID 14209950.
- ^ a b c d e f g h Breitinger U, Clausen T, Ehlert S, Huber R, Laber B, Schmidt F, Pohl E, Messerschmidt A (Haziran 2001). "Arabidopsis'ten sistatiyonin beta-liyazın üç boyutlu yapısı ve substrat özgüllüğü". Bitki Fizyolojisi. 126 (2): 631–42. doi:10.1104 / ss.126.2.631. PMC 111155. PMID 11402193.
- ^ a b c d e f Clausen T, Laber B, Messerschmidt A (1997-03-01). "Sistatiyonin beta-liyazın etki modu". Biyolojik Kimya. 378 (3–4): 321–6. PMID 9165088.
- ^ a b c Droux M, Ravanel S, Douce R (Ocak 1995). "Yüksek bitkilerde metiyonin biyosentezi. II. Ispanak kloroplastlarından sistatiyonin beta-liyazın saflaştırılması ve karakterizasyonu". Biyokimya ve Biyofizik Arşivleri. 316 (1): 585–95. doi:10.1006 / abbi.1995.1078. PMID 7840670.
- ^ a b c d e f Messerschmidt A, Worbs M, Steegborn C, Wahl MC, Huber R, Laber B, Clausen T (Mart 2003). "Cys-Met-metabolizması PLP'ye bağlı enzimler ailesindeki enzimatik özgüllüğün belirleyicileri: mayadan sistatiyonin gama-liyazın kristal yapısı ve tanıdık yapı karşılaştırması". Biyolojik Kimya. 384 (3): 373–86. doi:10.1515 / BC.2003.043. PMID 12715888. S2CID 24552794.
- ^ Alexander FW, Sandmeier E, Mehta PK, Christen P (Şubat 1994). "Piridoksal-5'-fosfata bağımlı enzimler arasındaki evrimsel ilişkiler. Bölgeye özgü alfa, beta ve gama aileleri". Avrupa Biyokimya Dergisi. 219 (3): 953–60. doi:10.1111 / j.1432-1033.1994.tb18577.x. PMID 8112347.
- ^ a b Ravanel S, Job D, Douce R (Aralık 1996). "Escherichia coli'de aşırı eksprese edilen Arabidopsis thaliana'dan sistatiyonin beta-liyazın saflaştırılması ve özellikleri". Biyokimyasal Dergi. 320 (Pt 2) (2): 383–92. doi:10.1042 / bj3200383. PMC 1217943. PMID 8973544.
- ^ Holbrook EL, Greene RC, Krueger JH (Ocak 1990). "Escherichia coli'nin aşırı üreten suşlarından sistatiyonin gama sentazın saflaştırılması ve özellikleri". Biyokimya. 29 (2): 435–42. doi:10.1021 / bi00454a019. PMID 2405903.
- ^ Kreft BD, Townsend A, Pohlenz HD, Laber B (Nisan 1994). "Buğdaydan (Triticum aestivum L.) Sistatiyonin y-Sentazın Saflaştırılması ve Özellikleri". Bitki Fizyolojisi. 104 (4): 1215–1220. doi:10.1104 / s.104.4.1215. PMC 159283. PMID 12232160.
- ^ Grishin NV, Phillips MA, Goldsmith EJ (Temmuz 1995). "Ökaryotik ornitin dekarboksilazların uzaysal yapısının modellenmesi". Protein Bilimi. 4 (7): 1291–304. doi:10.1002 / pro.5560040705. PMC 2143167. PMID 7670372.
- ^ Jansonius, JN (Aralık 1998). "B6 vitaminine bağımlı enzimlerin yapısı, gelişimi ve etkisi". Yapısal Biyolojide Güncel Görüş. 8 (6): 759–69. doi:10.1016 / s0959-440x (98) 80096-1. PMID 9914259.
- ^ a b c Clausen T, Huber R, Laber B, Pohlenz HD, Messerschmidt A (Eylül 1996). "1.83 A'da Escherichia coli'den piridoksal-5'-fosfata bağımlı sistatiyonin beta-liyazın kristal yapısı". Moleküler Biyoloji Dergisi. 262 (2): 202–24. doi:10.1006 / jmbi.1996.0508. PMID 8831789.
- ^ a b John RA (Nisan 1995). "Piridoksal fosfata bağımlı enzimler". Biochimica et Biophysica Açta (BBA) - Protein Yapısı ve Moleküler Enzimoloji. 1248 (2): 81–96. doi:10.1016 / 0167-4838 (95) 00025-p. PMID 7748903.
- ^ Aitken SM, Lodha PH, Morneau DJ (Kasım 2011). "Transsülfürasyon yollarının enzimleri: aktif bölge karakterizasyonları". Biochimica et Biophysica Açta (BBA) - Proteinler ve Proteomikler. 1814 (11): 1511–7. doi:10.1016 / j.bbapap.2011.03.006. PMID 21435402.
- ^ "ENZYME girişi 4.4.1.8". enzyme.expasy.org. Alındı 2017-03-09.
- ^ Gentry-Weeks CR, Spokes J, Thompson J (Mart 1995). "Bordetella avium'dan beta-Sistatiyonaz. Lizin 214'ün ve sistein kalıntılarının aktivite ve sitotoksisitedeki rolleri". Biyolojik Kimya Dergisi. 270 (13): 7695–702. doi:10.1074 / jbc.270.13.7695. PMID 7706318.
- ^ Clausen T, Huber R, Messerschmidt A, Pohlenz HD, Laber B (Ekim 1997). "Escherichia coli sistatiyonin beta-liyazın L-aminoetoksivinilglisin tarafından yavaş bağlanan inhibisyonu: kinetik ve X ışını çalışması". Biyokimya. 36 (41): 12633–43. doi:10.1021 / bi970630m. PMID 9376370.
- ^ Ravanel S, Gakière B, Job D, Douce R (Haziran 1998). "Bitkilerde metiyonin biyosentezi ve metabolizmasının spesifik özellikleri". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 95 (13): 7805–12. Bibcode:1998PNAS ... 95.7805R. doi:10.1073 / pnas.95.13.7805. PMC 22764. PMID 9636232.
- ^ Belfaiza J, Parsot C, Martel A, de la Tour CB, Margarita D, Cohen GN, Saint-Girons I (Şubat 1986). "Biyosentetik yollarda evrim: metiyonin biyosentezindeki ardışık adımları katalize eden iki enzim, ortak bir atadan kaynaklanır ve benzer bir düzenleyici bölgeye sahiptir". Amerika Birleşik Devletleri Ulusal Bilimler Akademisi Bildirileri. 83 (4): 867–71. Bibcode:1986PNAS ... 83..867B. doi:10.1073 / pnas.83.4.867. PMC 322971. PMID 3513164.
- ^ a b Ejim LJ, Blanchard JE, Koteva KP, Sumerfield R, Elowe NH, Chechetto JD, Brown ED, Junop MS, Wright GD (Şubat 2007). "Bakteriyel sistatiyonin beta-liyaz inhibitörleri: yeni antimikrobiyal ajanlara ve enzim yapısı ve işlevi problarına yol açar". Tıbbi Kimya Dergisi. 50 (4): 755–64. doi:10.1021 / jm061132r. PMID 17300162.
- ^ Jastrzębowska K, Gabriel I (Şubat 2015). "Antifungal ajanlar olarak amino asit biyosentezinin inhibitörleri". Amino asitler. 47 (2): 227–49. doi:10.1007 / s00726-014-1873-1. PMC 4302243. PMID 25408465.
