Sülfür tetraflorür ile florlama - Fluorination by sulfur tetrafluoride
Sülfür tetraflorür ile florlama alkoller, karbonil bileşikler, alkil halojenürler ve diğerleri dahil olmak üzere oksitlenmiş organik bileşiklerden organoflorin bileşikleri üretir.[1]
Sülfür tetraflorür karbonil bileşikleri, alkoller ve halojenürler dahil olmak üzere çeşitli organik fonksiyonel grupları florlamak için kullanılabilen gazlı bir reaktiftir. Karbonil bileşiklerinin muamelesi genellikle onları eşdeğer oksidasyon durumuna sahip organofloridlere dönüştürür: karboksilik asitler triflorometil bileşiklerine, ketonlar ve aldehitleri diflorürlere dönüştürür. nispeten hafif koşullar altında belirli bir site.
(1)

SF ile alkollerin ve halojenürlerin florlanması da mümkündür4. Ancak, SF4 oda sıcaklığında gaz halindedir ve bu reaktifi içeren birçok dönüşüm yüksek sıcaklıklar gerektirir ve bu da işlemeyi biraz zorlaştırır. Ek olarak, reaksiyon büyük miktarlarda üretir hidrojen florid. Bu endişeler, DAST gibi daha güvenli, daha sağlam florlama reaktiflerinin geliştirilmesine yol açmıştır (dietilaminosülfür triflorür ).[2]
Mekanizma ve Stereokimya
Hakim Mekanizma
SF ile florlama mekanizması4 belirsizdir ve alt tabakalara göre değişiklik gösterir. Başlangıçta alkoksisülfür triflorürler ara ürünler olarak önerildi;[3] ancak, izole alkoksisülfür triflorürlerin reaksiyonları hidrojen florid veya ısıtma, ilgili alkil florürleri sağlamamıştır.
(2)

Yakın diollerin diflorinasyon mekanizması iyi oluşturulmuştur,[4] ve bir hidroksil grubunda invertif saldırı ile ilerler ve ilave bir SF işleminden sonra diflorlu ürüne dönüştürülen bir florosülfit ara maddesi verir.4 ve HF. İkinci florlama, konfigürasyonun korunmasıyla devam eder. Florürün molekül içi iletimi burada mümkündür ve SF ile diğer bazı florlama vakalarında gözlenmiştir.4. SN1 mekanizmaları, kolayca karbokatyon oluşturan bileşikler için çalışır, SNDaha az iyonlaşabilen bileşiklerle 2 reaksiyon gerçekleşir.
(3)

Karboksilik asitlerin florlanması sadece beklenen triflorometil bileşiklerini değil aynı zamanda a-tetraflorlu eterleri de verir. Her iki ürünü de hesaba katacak bir mekanizma önerilmiş ve deneysel olarak desteklenmiştir.[5] Diflorometil katyonlarının oluşumunu açıklamak için florürün molekül içi aktarımı başlatılmıştır. Bir asil florür molekülünün bir diflorometil katyonuna saldırması, ardından ile nötralizasyon yerinde üretilen biflorür, a-tetraflorlu eter ürünlerine yol açar. Biflorür ile doğrudan reaksiyon, triflorometil içeren ürünleri verir.
(4)

Kapsam ve Sınırlamalar
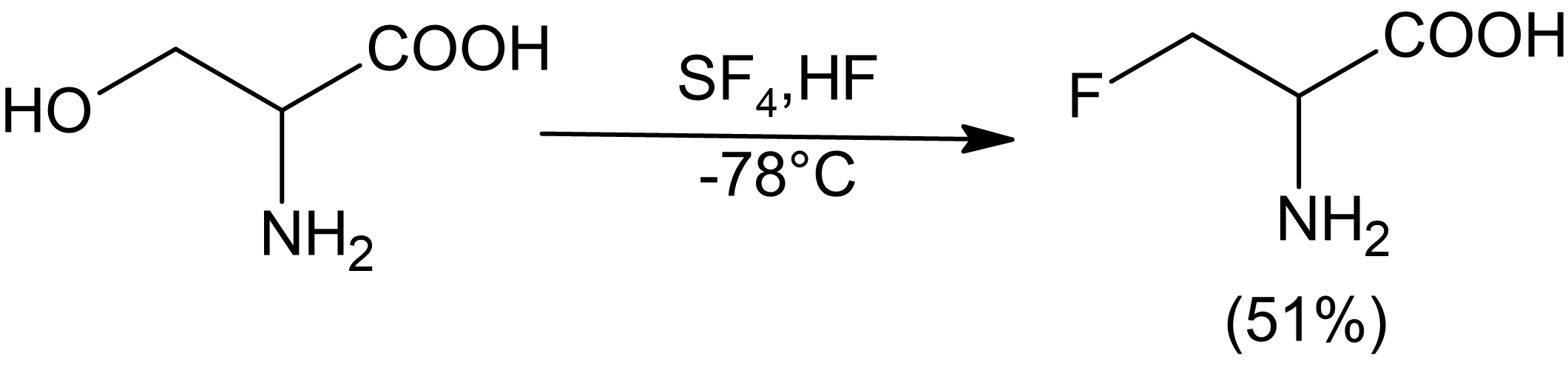
Sülfür tetraflorür, çeşitli fonksiyonel grupları kısmen veya tamamen florlanmış türevlerle değiştirmek için kullanılabilir. Sıvı hidrojen florür, SF ile bir çözücü ve katalizör olarak kullanılabilir4 alkolleri seçici olarak florlamak için.[6] SF4HF varlığında karbonil bileşikleri ile reaktivitesi artmaz. Genel olarak, SF ile yalnızca nispeten asidik alkoller verimli bir şekilde florlanabilir.4amino alkoller bu kuralın bir istisnası gibi görünse de.
(5)
Vicinal dioller SF ile birleştirildiğinde4alkollerden birinde konfigürasyonun tersine çevrilmesi ile diflorinasyon meydana gelir. Bu, sentezinde gösterilmiştir. mezo- (L) -tartrattan diflorosüksinat ve (D) - ve (L) -diflorosüksinatın sentezi mezo-tartrate.[7]
(6)

Karbonil bileşikleri genellikle SF ile reaksiyona girer4 geminal diflorürler elde etmek için. Reaksiyon süreleri saat mertebesinde olma eğilimindedir ve verim orta düzeydedir.[8]
(7)
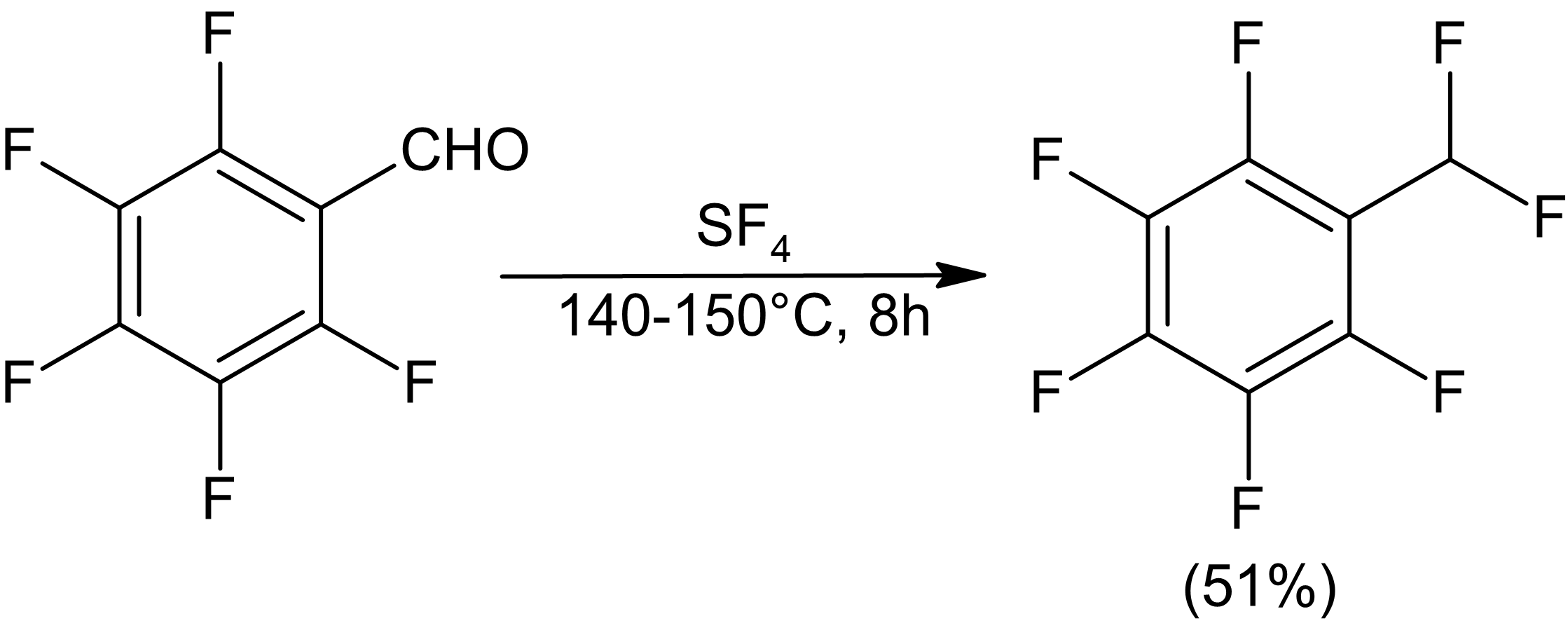
Laktonların florlanması heterosiklik floridler sağlayabilir, ancak p-butirolakton için halka açılması gözlemlenmiştir. Altı üyeli laktit, halka açılmasını tecrübe etmez.[9]
(8)

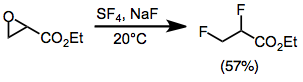
Florlama, çoğu durumda hem çift hem de komşu diflorürleri vermek için epoksitleri açar. Monoarlepoksitler, aril grubunun yer değiştirmesi ile birlikte ikiz ürünler verir. Sterik olarak engellenmiş iki ve üç ikameli epoksitler için verimler düşüktür. Bir ester grubu ile ikame edilmiş epoksitler, bir alkoksisülfür triflorür ara maddesi yoluyla yakın diflorürler verir.[10]
(9)
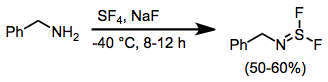
Aminler SF ile tedavi edildiğinde4 ve bir baz, iminosülfür diflorürler sonucu. Bu bileşiklerin alkali metal florürlerle daha fazla reaksiyona girmesi, nitril sülfitler dipolarofillerin varlığında [3 + 2] siklo-eklenme geçiren.[11]
(10)
Karboksilik asitler SF ile reaksiyona girer4 bir asil florür aracılığıyla triflorometil bileşikleri vermek. Tetrafloroalkil eterler ayrıca diflorometil katyon ve asil florür arasındaki reaksiyon yoluyla oluşur.[12]
(11)

Polimerleri verimli bir şekilde florlamak için kükürt tetraflorür kullanılabilir. Bunun genellikle polimer özellikleri üzerinde derin bir etkisi vardır - örneğin polivinil alkolün florlanması, güçlü asitlere ve bazlara karşı direncini artırır.[13]
Sentetik Uygulamalar
C-16'da bir triflorometil grubu taşıyan bir prostaglandinin sentezi, bir karboksilik asidin sülfür tetraflorür ile florlanmasıyla elde edilen bir ara maddeye dayanır.[14]
(12)

Diğer Yöntemlerle Karşılaştırma
Modern florlama yöntemleri, sülfür triflorürü esasen geçersiz kılmıştır. Daha kolay işlenen reaktif DAST'ın kullanımı (dietilaminosülfür triflorür ) artık SF'ye tercih ediliyor4 nükleofilik florinasyon reaksiyonları için. DAST, alkollerin florlanmasında daha seçicidir ve aside duyarlı substratlarda daha az yeniden düzenleme ve eliminasyonu destekler. Gaz halindeki SF ile işlemenin zahmeti4 bu reaktifi kullanan florinasyonların bir dezavantajıdır. Ek olarak, HF kullanılıyorsa, aside dayanıksız işlevsellik substratta mevcut olamaz. Elektrofilik florlama reaktifleri, örneğin Selectfluor ve N-fluorosulfonimides, SF'nin reaktivitesini tamamlar4 ve bu sorunlardan kaçının.[15]
(13)

Deneysel Koşullar ve Prosedür
Tipik Koşullar
Sülfür tetraflorür, -38 ° C'de kaynamasına rağmen oda sıcaklığında renksiz bir gazdır. Sulu ortamda hızla hidrolize olur ve aşındırıcı ve toksiktir; bu nedenle reaksiyonlar, eldiven ve gözlüklerle iyi havalandırılan bir davlumbazda gerçekleştirilmelidir. Sülfür tetraflorür paslanmaz çelik, bakır veya nikel ile reaksiyona girmez. Normalde SF ile florlama reaksiyonları4 paslanmaz çelik bir sallama aparatında gerçekleştirilir. Gazlı reaktifler çalkalayıcıya yoğunlaştırma ile verilir ve gazlı ürünler genellikle reaksiyon tamamlandığında havalandırılır (gazlı ürünler ilgilenilmediği sürece, bu durumda ayrı bir kapta yoğunlaştırılabilirler). Hidrojen florür, reaksiyon karışımının suya dökülmesi ve ardından filtrasyon yoluyla istenen ürünlerden ayrılabilir. Kalsiyum hidroksit çözeltileri de bu bağlamda kullanılabilir ve zararsızdır. kalsiyum florür.
Örnek Prosedür[16]
(14)

5-Hidroksihistamin dihidroklorür (1700 mg, 3.5 mmol), 25 mL susuz sıvı HF içerisinde çözündürüldü ve çözelti, HCI'yi çıkarmak için bir kuru nitrojen akışı içerisinde buharlaştırıldı. Kalıntı, -78 ° C'de 40 mL HF içinde yeniden çözündürüldü, 2.3 mL SF ile işlendi4 (40.3 mmol) ve 2.5 saat 0 "C'ye ısıtıldı. -78" C'ye yeniden soğutulduktan sonra, ilave 2 mL SF4 çözelti içinde yoğunlaştırıldı. Reaktör daha sonra gece boyunca oda sıcaklığına ısınmasına izin verilen bir buz banyosuna (yaklaşık 1 L) daldırıldı. Daha sonra HF, bir N akışında çıkarıldı.2, kalıntı 25 mL 2.5 N HCl içinde çözüldü ve çözelti konsantre edildi vakumda sakızlı bir kalıntıya. Bu, 150 mL Dowex 50X8'e uygulandı ve 200 mL H ile elute edildi.2O, 400 mL 1 N HCl ve yakl. 1L 2.5 N HCl. Ninhidrin pozitif fraksiyonlar (2.5 N HCl), 500 mg kristalli B-florohistamin dihidroklorüre (% 71) konsantre edildi: 130 ° C'de bu sıcaklıkta eklendiğinde ayrışma; 60-MHz 1H NMR (D2O-DCl) δ 3.3-4.2 (geniş çoklu, 2 H), 6.27 (dört satırlı katların ikilisi, 1 H, JHF = 47 Hz), 7,83 (m, 1 H, JHF = 2 Hz), 9.0 (s, 1 H). Anal. Calc'd. C için5H10N3FCl2: C, 29,70; H, 4,95; N, 20.80; F, 9.40. Bulunan: C, 29.69; H, 4,94; N, 20,51; F, 9,72.
Referanslar
- ^ Wang, C.-L. J. Org. Tepki. 1985, 34, 319. doi:10.1002 / 0471264180.or034.02
- ^ Hudlicky, M. Org. Tepki. 1988, 35, 513.
- ^ Hasek, R .; Smith, C .; Engelhardt, A. J. Am. Chem. Soc. 1960, 82, 543.
- ^ Burmakov, I .; Motnyak, A .; Kunshenako, V .; Alexseeva, A .; Yagupol'skii, M. J. Fluorine Chem. 1981, 19, 151.
- ^ Dmowski, W .; Kolinski, A. Pol. J. Chem. 1978, 52, 547.
- ^ Kollonitsch, J .; Marburg, S .; Perkins, M. J. Org. Chem. 1975, 40, 3808.
- ^ Bell, M .; Hudlicky, M. J. Fluorine Chem. 1980, 15, 191.
- ^ Mobbs, H. J. Fluorine Chem. 1971, 1, 361.
- ^ Muratov, N .; Burmakov, I .; Kunshenko, V .; Alekseeva, A .; Yagupol'skii, M. J. Org. Chem. SSCB (İngilizce Çevr.) 1982, 18, 1220.
- ^ Yagupol'skii, M .; Golikov, I .; Alekseeva, A .; Aleksandrov, M. J. Org. Chem. SSCB (İngilizce Çevr.) 1971, 7, 737.
- ^ Grunwell, R .; Boya, L. Tetrahedron Lett., 1975, 1739.
- ^ Dmowski, W .; Kolinski, A. Rocz. Chem. 1974, 48, 1697.
- ^ Bezsolitsen, P .; Gorbunov, N .; Nazarov, A .; Khardin, P. Vysokomol. Soedin., Ser. Bir 1972, 14, 950 [C.A., 77, 75710e (1972)].
- ^ Holland, G. W .; Jernow, J. L .; Rosen, P. U.S. Pat. 4,256,911 (1981) [C.A., 89, 146500x (1978)].
- ^ Badoux, J .; Cahard, D. Org. Tepki. 2007, 69, 347.
- ^ Burmakov, I .; Motnyak, A .; Kunshenko, V .; Alekseeva, A .; Yagupol'skii, M. J. Org. Chem. SSCB (İngilizce Çevr.) 1980, 16, 1204.
