Triborasiklopropenil - Triboracyclopropenyl

triborasiklopropenil parça bir döngüsel yapısal motif bor kimya, geometrik benzerliğinden dolayı siklopropen. Düzlemsel olmayanın aksine boran kümeleri daha yüksek sergileyen koordinasyon numaraları borda (ör. 3 merkezli 2 elektronlu bağlar köprü kurmak hidrürler veya katyonlar ), triborasiklopropenil tipi yapılar, her bir bordaki ikame edicilerin de olduğu üç bor atomunun halkalarıdır. aynı düzlemde yüzüğe. Triborasiklopropenil içeren bileşikler, aşırı inorganik vakalardır. aromatiklik. Tamamen kaynaklı bağlanma ve manyetik özellikleri sergilediği bilinen en hafif ve en küçük döngüsel yapılardır. yerelleştirilmiş elektronlar yörüngelerinde σ ve π simetri. Üç üyeli bor halkaları sıklıkla çok gergin deneysel olarak erişilemez, ayırt edici aromatikliklerine akademik ilgi ve ara maddeler olarak olası rolü Borane piroliz, kapsamlı hesaplama çalışmalarını motive etti. teorik kimyagerler.[1][2][3][4] 1980'lerin sonlarından başlayarak kütle spektrometrisi Anderson tarafından çalışmak ve diğerleri. tüm bor kümeleri üzerinde, triborasiklopropenillerin deneysel çalışmaları onlarca yıldır yalnızca en basit halkaların (B iyonları) gaz fazı araştırmalarıyla sınırlıydı.3).[4][5][6] Bununla birlikte, daha yeni çalışmalar, triborasiklopropenil parçasını donöre koordinasyon yoluyla stabilize etmiştir. ligandlar veya geçiş metalleri, kimyasının kapsamını önemli ölçüde genişletiyor.[7][8][9][10]
Sentez
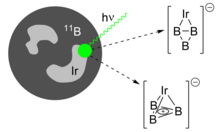
Gaz fazlı spektroskopik çalışmalar için, triborasiklopropenil içeren bileşikler, lazer ablasyon bor hedefleri ve sonuçta ortaya çıkan plazma bulutunun helyum gibi bir inert taşıyıcı gaz akışında kolimasyonu. İlgili yüklü moleküller daha sonra kütle olarak seçilir. Uçuş süresi kütle spektrometrisi. Gibi gazların eklenmesi N2 veya CO gaz akışına karşılık gelen eklentiler gibi metallerin eklenmesi sırasında iridyum ve vanadyum B hedefine karşılık gelen metal katkılı kümeleri verir.[11]
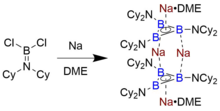
Çözelti içinde ve katı halde devam eden bir triborasiklopropenil anyonunun izole edilebilir tek örneği, Braunschweig ve arkadaşları tarafından, onu azaltarak sentezleyen aminoboran Cl2B = NCy2 (Cy = sikloheksil ) içinde ince dağılmış sodyum metal ile dimetoksietan (DME).[7] Na dimerik türlerin elde edilen turuncu-kırmızı çözeltisinin soğutulması4[B3(NCy2)3]2 • 2 DME, aşağıdakiler için uygun kristaller sağladı: X-ışını difraksiyon, yapının belirlendiği. Ayrıntılı indirgeme mekanizması bilinmemekle birlikte, subvalent "R2N − B "ara ürünleri, bu tür bor kümelerinin oluşumunda rol oynar.[12]
Yapı ve bağ
En basit aromatik döngüler olarak özel statülerinden dolayı, triborasiklopropenil türevlerinin elektronik yapısı, çeşitli tekniklerle analiz edilmiştir. hesaplamalı kimya. Bunlar kanonik arasında değişiyor moleküler yörünge teorisi adaptif doğal yoğunluk bölümleme teorisi gibi alternatif bağ formülasyonlarına,[13] moleküllerde atomların kuantum teorisi, doğal bağ yörünge teorisi kimyasal değerlik için doğal orbitaller[14] ve elektron lokalizasyon işlevi analizi. NICS ve halka akımı hesaplamaları da bu tür sistemlerdeki aromatikliği manyetik kriterler kullanarak karakterize etmek için kullanılmıştır.[15] Genel olarak, bu döngülerin son derece küçük boyutu, bağ elektronlarının önemli derecede Coulomb itmesi yaşadığını ve bunun da anormal derecede yüksek halka gerginliği.[16] Bu etki, aromatik delokalizasyon tarafından sunulan stabilizasyonla kısmen telafi edilir.
B3+
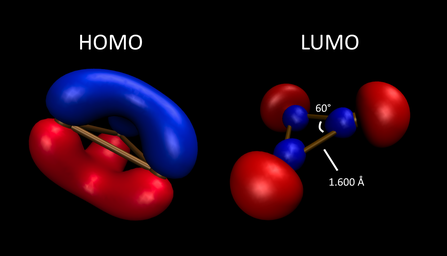
B3+ ile ilişkili aromatikliği gösterir a2'' -simetrik HOMO. Onun içinde atlet elektronik temel durum, bu bir Hückel 2π elektron sistemi siklopropenium katyonu ama izole edilemeyecek kadar reaktif. D ile üçgendir3 sa. simetri - tüm B atomları ve B-B bağ mesafeleri kimyasal olarak eşdeğerdir. Gaz fazı eklentileri B3(N2)3+ ve B3(CO)3+ ETS-NOCV (genişletilmiş geçiş durumu - kimyasal değerlik için doğal orbitaller) teorisi aracılığıyla hesaplamalı olarak incelenmiştir; bu teori, enerji ve elektron yoğunluğundaki değişiklikleri inceleyen, etkileşimde bulunmayan parçaların referans durumundan hazırlanmıştır.[17] ETS-NOCV enerji ayrışma analizi, NOCV'nin2 ve CO eklentileri, ekzosiklik ligandların yüksek düzeyde elektron eksikliği olan bor halkasına σ bağışlanması yoluyla temel olarak stabilize edilir (sırasıyla -83.6 ve -112.3 kcal / mol ile). Sonuç olarak, her biri bir B olarak yorumlandı3+ tarafından desteklenen parça datif bağ N'den2 veya CO. Bu sistemin NOCV'lerinden oluşturulan elektron deformasyon yoğunluğu, doğal bağ yörünge popülasyonlarından türetilen yüklerle birlikte, B'nin tüm eşdeğer bağlarını indükleyen ekzosiklik liganddan halkaya elektron akışını gösterir.3+ çekirdek yaklaşık 4 pm kısaltacak. π-simetri etkileşimleri hem zayıf σ verici N ile gözlenir.2 ve güçlü π alıcı ligand CO. Bununla birlikte, düzlem dışı π backdonation (B'nin π sisteminden)3 her ligandın π alıcı orbitallerine halka), düzlem içi π backdonasyondan daha az stabilize eder, [B için -26.7 ve -19.6 kcal / mol güçleri ile3(CO)2+ + CO] sistemi. Bu, molekülün minimum enerji konfigürasyonunun, B'deki maksimum π aromatikliği koruyan bir konfigürasyon olduğunu gösterir.3+ çekirdek.
Tıpkı aromatik türler gibi siklopentadienil anyon ve siklopropenium katyonu geçiş metallerine koordine edebilir, yakın zamanda B3+ halka metal merkezlere bağlanabilir.[18] Karışık bir B / Ir hedefinin lazer ablasyonu iki IrB izomeri üretir3−, bir B3+ resmi bir Ir ile koordine edilmiş halka2- anyon. Bunlar sözde düzlemsel η2 eklenti ve dört yüzlü η3 ikincisi aromatik bir triborasiklopropenil parçası içeren eklenti. Her ikisi de enerji bakımından neredeyse aynıdır ve üretilen küme ışını içinde bir arada bulunur.

Hesaplamalar, B'nin3+ Olağandışı bir bileşik B ailesi oluşturmak için asal asal gaz atomlarını bile bağlayabilir3(Rg)3+ (Rg = nadir / asal gaz), Rg p-orbital σ donisitesinden kaynaklanan ihmal edilemez bağ kuvvetlerine (15-30 kcal / mol'den) ve Rg'den B'ye önemli derecede yük aktarımına sahip3+. Yeni olasılığı soy gaz bileşikleri ekzotermik ve kendiliğinden oluşan bu, deneysel çalışma için bir fırsattır.[19][21]
B3
B3 tek başına işgal edilmiş bir1Halkanın çekirdeğine doğru yönlendirilmiş σ-simetrik orbitallerden oluşan, σ yer değiştirme ve B'ye kıyasla biraz daha kısa B-B bağ uzunlukları ile ilişkili HOMO (bir SOMO)3+. İkili temel durum ile paramanyetiktir.[22] Polar olmayan, düz ve üçgen olup D3 sa. simetri.
B3−
B3−dolu bir1D'de HOMO3 sa. simetri, "çift" aromatik ve nispeten kararlı olarak kabul edilir - eşzamanlı olarak sırasıyla HOMO ve HOMO-1'de yüksek oranda yer değiştirmiş σ ve π elektronlarına sahiptir.[23][24]
B3R32-
B3R32-datif oklar yerine elektron paylaşımlı B − R bağları ile formüle edilmiş, B'ye izoelektroniktir3+. Triborasiklopenil çekirdeğe 8 elektron atanır, 6'sı bağ orbitallerinde ve 2'si π sisteminde Hückel aromatikliği ile sonuçlanır. Bu sınıfın deneysel olarak karakterize edilen tek bileşiği Na'dır.4[B3(NCy2)3]2 • 2 DME, bir yığılmış B dimer3R32- kendileri aromatik olan birimler.[7] Doğal bağ yörünge analizi, bu bileşiğin, lokalize B − B bağ orbitallerinin, halka boyunca karşılık gelen B − N antibonding yörüngesiyle bir donör-alıcı etkileşimi ile oldukça stabilize edildiğini (kabaca 45 kcal / mol) gösterir. Na köprüleme elektrostatik çekim+ kristal yapıda tanımlanan katyonlar. DFT hesaplamalar, HOMO ve HOMO-1'in sırasıyla ayrı bir halkanın π HOMO'sunun antisimetrik ve simetrik kombinasyonları olduğunu göstermektedir - metalosenler. Resmi MO bağ sırasına sahip olan B − B bağlarına sahip bir tür için beklendiği gibi 1.62 Å'luk ortalama B-B bağ uzunluğu, kabaca 1.75 Å'luk B bond B tekli bağlarından daha diboren (R-B = B-R) radikal katyonlarınınkine daha yakındır.
Spektroskopi ve spektrometri
Triborasiklopropenil türevi bileşikler, ilk olarak, katyonik bor kümelerinin karmaşık karışımlarının kütle spektrometrisinde geçici türler olarak, kütle-yük oranları ile tanımlandı.[5] O ile reaktif saçılma çalışmaları2 Bunu kısa süre sonra izledi ve hafif bor kümeleri içindeki nispeten güçlü bağları ortaya çıkardı.[6] Daha sonra, B3 oldu matrislerde izole edilmiş donmuş asal gazlar ve elektron paramanyetik rezonans D değerini doğrulayan spektrumlar kaydedildi3 sa. geometri.[22] Eşleştirilmemiş elektronun aşırı ince bağlanması 11B çekirdeği, a için% 15 s-yörünge karakteri tahmini sağlamıştır.1'HOMO. Küçük ve polar olmayan B3 halkalar matris içinde hapsedildiklerinde bile serbestçe yuvarlanıp dönebiliyordu.
Genel olarak, triborasiklopropenil içeren türler çok kısa ömürlüdür ve iletim modu için yetersiz miktarda üretilmiştir. kızılötesi spektroskopi. Ancak, ayrışan B3(N2)3+ Kızılötesi ışıkla ve kütle spektrometresi yoluyla karşılık gelen kütleden şarj sinyalinin bozulmasının gözlemlenmesi, B'nin etkili bir kızılötesi spektrumuna izin verdi3(N2)3+ kaydedilecek.[17][25] Bu titreşimsel foto-ayrışma spektrumu, 98 cm'lik bir kırmızıya kayma ile yalnızca tek bir algılanabilir titreşim içeriyordu.−1 gaz halindeki N'ye göre2, oldukça simetrik bir B'yi düşündürür3(N2)3+ biraz zayıflatılmış N≡N bağına sahip eklenti.
Triborasiklopropenil içeren negatif yüklü iyonların, aşağıdakilerle çalışmaya uygun olduğu kanıtlanmıştır: fotoelektron spektroskopisi. Tarafından Koopman teoremi, güçlünün etkilerini ihmal ederek elektron korelasyonu X-ışınları ile ayrılan elektronların kinetik enerjileri, tek tek orbitallerin bağlanma enerjilerine eşlenebilir ve moleküler elektronik yapıyı ortaya çıkarabilir.[26][27] Ortaya çıkan spektral zirvelerin "titreşimsel ilerleme " (göre Franck-Condon prensibi) farklı enerjilerdeki iyonlaşmanın molekülün belirli titreşim frekanslarını nasıl değiştirdiğini gösterir ve bağlanma üzerindeki bu etkiler elektron konfigürasyonundaki değişiklikler olarak yorumlanır. B'de3−bir multielektron veya "sallama" geçişine karşılık gelen alışılmadık derecede yüksek yoğunluklu ve yüksek enerjili bir bant (birleştirilmiş elektron ayrılması ve elektronik uyarma) gözlemlendi, bu da triborasiklopropenil fragmanında bulunan güçlü elektron korelasyonunu düşündürdü.[4] IrB için3−IrB'nin gerilme ve nefes alma titreşimlerinden kaynaklanan titreşimsel ilerleme3 küme kirişinde bulunan her iki izomerin örtüşen spektrumlarında atanabilir. Hesaplamalara kıyasla, IrB'nin minimum enerji yapısı3 daha sonra bozulmamış, aromatik bir B ile bir tetrahedron olarak formüle edilebilir3+ parça.[8]
Reaktivite
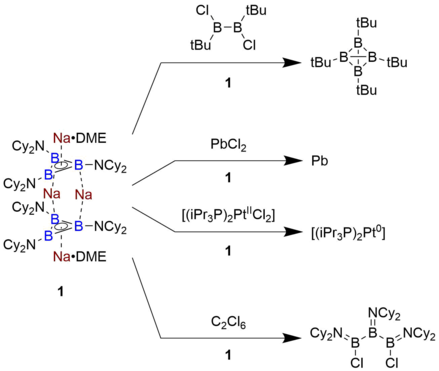
Triborasiklopropenil içeren bileşiklerin reaktivitesi, çözelti fazında yalnızca bir örnek hazırlandığından, nispeten az araştırılmıştır. Braunschweig, Na tarafından bildirilen bileşik4[B3(NCy2)3]2 • 2 DME, ferrosen / ferrosenyum çiftine kıyasla -2.42 V oksidasyon potansiyeline sahip son derece güçlü bir indirgeyicidir. Sonuç olarak, kloroboranları indirgeyerek PbCl'yi azaltmanın yanı sıra tetrahedral B kümeleri elde edebilir.2 doğrudan metalik Pb'ye. Ek olarak, B'de bir halka açma reaksiyonuna girecektir.3 Klor atomlarını soyutlayarak kısım heksakloroetan. Bu indirgeme gücü seviyesi kabaca bir alkali metal ile karşılaştırılabilir ve daha önce organik bir çerçeveye dayalı herhangi bir molekül için gözlemlenmemiştir.[7]
Geçiş metali katkılı üç çekirdekli bor kümelerinin çoğu örneğinin aromatik bir triborasiklopropenil fragmanı içermemesine rağmen, bu türlerin küçük moleküller ile reaktivitesinin artan bilimsel ilgiyi çekmesi muhtemeldir. VB'nin kütle spektrometresi koşulları altında3+ VB ürünlerini sağlamak için metanı dehidrojenize eder3CH2+ ve H2. VH üreten küçük bir yan reaksiyon+ ve B'yi ortadan kaldırır3CH3 aynı zamanda etkindir.[10]
Ayrıca bakınız
Referanslar
- ^ McKee, Michael L .; Buehl, Michael; Charkin, Oleg P .; Schleyer, Paul - R. (1993-10-01). "Bor türevlerini içeren dört merkezli iki elektron bağının teorik olarak incelenmesi". İnorganik kimya. 32 (21): 4549–4554. doi:10.1021 / ic00073a014. ISSN 0020-1669.
- ^ Korkin, Anatoli A .; Schleyer, Paul - R .; McKee, Michael L. (1995-02-01). "Nötr ve Yüklü B3Hn (n = 3-9) Türlerinin Teorik ab Başlangıç Çalışması. Yapısal Tercihlerin Belirlenmesinde Aromatikliğin Önemi". İnorganik kimya. 34 (4): 961–977. doi:10.1021 / ic00108a031. ISSN 0020-1669.
- ^ Yang, C. L; Zhu, Z.H (2001-08-27). "B3 + 'nın yer atleti ve alçakta yatan üçlü elektronik halleri". Moleküler Yapı Dergisi: THEOCHEM. 571 (1): 225–229. doi:10.1016 / S0166-1280 (01) 00558-9. ISSN 0166-1280.
- ^ a b c Zhai, Hua-Jin; Wang, Lai-Sheng; Alexandrova, Anastassia N .; Boldyrev, Alexander I .; Zakrzewski, Vyacheslav G. (2003-11-01). "Fotoelektron Spektroskopisi ve B3- ve B4-Anyonları ve Nötrallerinin Ab Başlangıç Çalışması". Fiziksel Kimya Dergisi A. 107 (44): 9319–9328. Bibcode:2003JPCA..107.9319Z. doi:10.1021 / jp0357119. ISSN 1089-5639.
- ^ a b Hanley, Luke .; Anderson, Scott L. (1987-09-01). "Küçük bor kümesi iyonlarının üretimi ve çarpışmadan kaynaklanan ayrışması". Fiziksel Kimya Dergisi. 91 (20): 5161–5163. doi:10.1021 / j100304a007. ISSN 0022-3654.
- ^ a b Hanley, Luke; Anderson, Scott L. (1988-09-01). "Küçük bor kümesi iyonlarının (B + 1–13) oksijenle oksidasyonu". Kimyasal Fizik Dergisi. 89 (5): 2848–2860. Bibcode:1988JChPh..89.2848H. doi:10.1063/1.454989. ISSN 0021-9606.
- ^ a b c d e f Kupfer, Thomas; Braunschweig, Holger; Radacki, Krzysztof (2015-12-07). "Triborasiklopropenil Dianion: Olası En Hafif Ana Grup-Element Hückel π Aromatik". Angewandte Chemie Uluslararası Sürümü. 54 (50): 15084–15088. doi:10.1002 / anie.201508670. PMID 26530854.
- ^ a b c Czekner, Joseph; Cheung, Ling Fung; Kocheril, G. Stephen; Kulichenko, Maksim; Boldyrev, Alexander I .; Wang, Lai-Sheng (2019-06-24). "IrB 3'ün Yüksek Çözünürlüklü Fotoelektron Görüntülemesi -: Geçiş Metaline Koordineli bir π-Aromatik B 3 + Halkasının Gözlenmesi". Angewandte Chemie Uluslararası Sürümü. 58 (26): 8877–8881. doi:10.1002 / anie.201902406.
- ^ Chen, Xin; Chen, Teng-Teng; Li, Wan-Lu; Lu, Jun-Bo; Zhao, Li-Juan; Jian, Tian; Hu, Han-Shi; Wang, Lai-Sheng; Li, Haziran (2019-01-07). "PrB 3 - ve PrB 4 - Borür Kümelerinde Olağandışı Düşük Oksidasyon Durumlarına Sahip Lantanitler". İnorganik kimya. 58 (1): 411–418. doi:10.1021 / acs.inorgchem.8b02572. ISSN 0020-1669. PMID 30543295.
- ^ a b Chen, Qiang; Zhao, Yan-Xia; Jiang, Li-Xue; Li, Hai-Fang; Chen, Jiao-Jiao; Zhang, Ting; Liu, Qing-Yu; O, Sheng-Gui (2018). "Metanın vanadyum borür küme katyonları VB n + (n = 3–6) ile termal aktivasyonu". Fiziksel Kimya Kimyasal Fizik. 20 (7): 4641–4645. Bibcode:2018PCCP ... 20.4641C. doi:10.1039 / C8CP00071A. ISSN 1463-9076. PMID 29379936.
- ^ Jian, Tian; Chen, Xuenian; Li, Si-Dian; Boldyrev, Alexander I .; Li, Jun; Wang, Lai-Sheng (2019). "Boyuta göre seçilmiş bor ve katkılı bor kümelerinin yapılarının ve bağlanmasının incelenmesi". Chemical Society Yorumları. 48 (13): 3550–3591. doi:10.1039 / C9CS00233B. ISSN 0306-0012. PMID 31120469.
- ^ Wrackmeyer, Bernd (2016). "Bir Siklotriboran Dianyonu ve Triboron Katyonu: Hückel Kuralının" Işık Sonu ". Angewandte Chemie Uluslararası Sürümü. 55 (6): 1962–1964. doi:10.1002 / anie.201510689. ISSN 1521-3773.
- ^ Tkachenko, Nikolay V .; Boldyrev, Alexander I. (2019-05-08). "Uyarlanabilir doğal yoğunluk bölümleme yöntemini kullanarak uyarılmış durumların kimyasal bağ analizi". Fiziksel Kimya Kimyasal Fizik. 21 (18): 9590–9596. Bibcode:2019PCCP ... 21.9590T. doi:10.1039 / C9CP00379G. ISSN 1463-9084.
- ^ Mitoraj, Mariusz P .; Michalak, Artur; Ziegler, Tom (2009/04/14). "Bağ Analizi için Kombine Yük ve Enerji Ayrıştırma Şeması". Kimyasal Teori ve Hesaplama Dergisi. 5 (4): 962–975. doi:10.1021 / ct800503d. ISSN 1549-9618. PMID 26609605.
- ^ Pham, Hung Tan; Lim, Kie Zen; Havenith, Remco W. A .; Nguyen, Minh Tho (2016/04/28). "Halka akımı hesaplamaları ile yeniden ziyaret edilen düzlemsel bor bazlı kümelerin aromatik karakteri". Fiziksel Kimya Kimyasal Fizik. 18 (17): 11919–11931. Bibcode:2016PCCP ... 1811919P. doi:10.1039 / C5CP07391J. hdl:1854 / LU-8549871. ISSN 1463-9084. PMID 26956732.
- ^ Himmel, Hans-Jörg (2019-08-19). "Elektron Eksik Triboran ve Tetraboran Halka Bileşikleri: Sentez, Yapı ve Bağlanma". Angewandte Chemie Uluslararası Sürümü. 58 (34): 11600–11617. doi:10.1002 / anie.201900563. PMID 30786130.
- ^ a b Jin, Jiaye; Wang, Guanjun; Zhou, Mingfei; Andrada, Diego M .; Hermann, Markus; Frenking, Gernot (2016/02/05). "En Küçük π-Aromatik Tür B 3 + İçeren [B 3 (NN) 3] + ve [B 3 (CO) 3] + Kompleksleri". Angewandte Chemie Uluslararası Sürümü. 55 (6): 2078–2082. doi:10.1002 / anie.201509826. PMID 26836340.
- ^ Lichtenberger, Dennis L .; Hoppe, Martin L .; Subramanian, Lalitha; Kober, Edward M .; Hughes, Russell P .; Hubbard, John L .; Tucker, David S. (1993-06-01). ".Eta.3-siklopropenil-metal komplekslerinde elektron dağılımı ve bağlanması". Organometalikler. 12 (6): 2025–2031. doi:10.1021 / om00030a011. ISSN 0276-7333.
- ^ a b c Li, Zhuo Zhe; Li, An Yong (2017/07/26). "Bor ve nadir gazların monosiklik aromatik bileşikleri BnRgn (n − 2) +". Fiziksel Kimya Kimyasal Fizik. 19 (29): 19109–19119. Bibcode:2017PCCP ... 1919109L. doi:10.1039 / C7CP00316A. ISSN 1463-9084. PMID 28702603.
- ^ Lu, Tian; Chen, Feiwu (2012). "Multiwfn: Çok fonksiyonlu bir dalga fonksiyonu analizörü". Hesaplamalı Kimya Dergisi. 33 (5): 580–592. doi:10.1002 / jcc.22885. ISSN 1096-987X. PMID 22162017.
- ^ Saha, Ranajit; Pan, Sudip; Mandal, Subhajit; Orozco, Mesías; Merino, Gabriel; Chattaraj, Pratim K. (2016-08-17). "Soy gaz destekli B3 + kümesi: güçlü kovalent soy gaz-bor bağlarının oluşumu". RSC Gelişmeleri. 6 (82): 78611–78620. doi:10.1039 / C6RA16188J. ISSN 2046-2069.
- ^ a b Hamrick, Y. M .; Van Zee, R. J .; Weltner, W. (1992-02-01). "Bor ve alüminyum trimerler için elektron spin rezonansı ve temel durumları". Kimyasal Fizik Dergisi. 96 (3): 1767–1775. Bibcode:1992JChPh..96.1767H. doi:10.1063/1.462132. ISSN 0021-9606.
- ^ Alexandrova, Anastassia N .; Boldyrev, Alexander I .; Zhai, Hua-Jin; Wang, Lai-Sheng (2006-11-01). "Potansiyel yeni inorganik ligandlar ve kimyadaki yapı taşları olarak tüm bor aromatik kümeler". Koordinasyon Kimyası İncelemeleri. 18. Ana Grup Kimyası. 250 (21): 2811–2866. doi:10.1016 / j.ccr.2006.03.032. ISSN 0010-8545.
- ^ Yang, Li-ming; Wang, Jian; Ding, Yi-hong; Güneş, Chia-chung (2007-08-29). "Bor Kimyasında Tipik Üçgen Yapı B 3'ün İncelenmesi: Ligandlar veya Yapı Taşları Olarak Kullanılan Çıplak Tüm Bor Kümelerine Bakış". Fiziksel Kimya Dergisi A. 111 (37): 9122–9129. Bibcode:2007JPCA..111.9122Y. doi:10.1021 / jp074645y. ISSN 1089-5639. PMID 17725336.
- ^ Wang, GuanJun; Chi, ChaoXian; Xing, XiaoPeng; Ding, ChuanFan; Zhou, MingFei (2014/01/01). "Kütle seçilmiş iyonların kızılötesi foto-ayrışma spektroskopisi için bir eşdoğrusal tandem uçuş zamanı kütle spektrometresi". Bilim Çin Kimyası. 57 (1): 172–177. doi:10.1007 / s11426-013-4979-5. ISSN 1869-1870.
- ^ Lineberger, W. Carl (2013-04-01). "Bir Zamanlar Anyon: Bir Foto Ayrılma Hikayesi". Fiziksel Kimya Yıllık İncelemesi. 64 (1): 21–36. Bibcode:2013 ARPC ... 64 ... 21L. doi:10.1146 / annurev-physchem-032511-143753. ISSN 0066-426X.
- ^ Truhlar, Donald G .; Hiberty, Philippe C .; Shaik, Sason; Gordon, Mark S .; Danovich, David (2019-09-02). "Orbitaller ve Fotoelektron Spektroskopisinin Yorumlanması ve (e, 2e) İyonizasyon Deneyleri". Angewandte Chemie Uluslararası Sürümü. 58 (36): 12332–12338. doi:10.1002 / anie.201904609.


